Cuando nos enfrentamos a un problema termodinámico necesitamos saber en cual fase se encuentra nuestra sustancia para conocer los cambios en las propiedades termodinámicas. No basta solo con conocerlas, necesitamos ubicarnos. Por esta razón existen los diagramas termodinámicos.
Tabla de contenido
¿Qué es un diagrama termodinámico?
Un diagrama termodinámico no es más que una representación gráfica de la variación que experimentan las propiedades de la sustancia durante los cambios de fase.
Existen dos tipos de diagramas termodinámicos para visualizar en cual fase se encuentra nuestra sustancia:
Gráfica T vs V

Gráfica P vs V

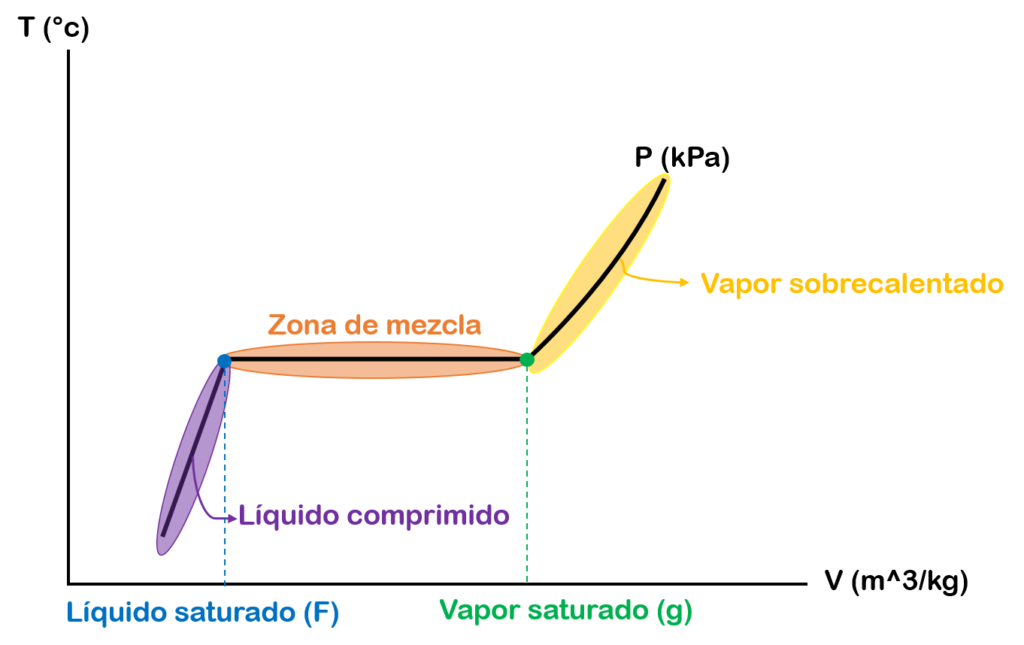
Diagrama de temperatura vs volumen específico
En la gráfica de temperatura vs volumen específico tenemos en el eje Y la temperatura, en el eje X el volumen específico y la línea de la mitad representa una isobárica o linea de presión constante.
Pero debes tener en cuenta que en el eje X no solo puede ir el volumen, también puedes colocar otras propiedades como la energía interna, la entalpía y la entropía.

Pero ¿Cómo sabemos en que fase está la sustancia en el diagrama T vs V?
Para conocer la fase en que se encuentra nuestra sustancia vamos a dividir el diagrama por partes o zonas.
La primera zona que tenemos es la zona de líquido comprimido o líquido subenfriado. En esta zona la sustancia se encuentra líquida.

La segunda zona es un punto específico el cual se conoce como líquido saturado (f). En este punto la sustancia líquida esta próxima a evaporarse.

La tercera zona que tenemos es la zona de vapor húmedo o mezcla saturada de líquido – vapor. En esta zona la sustancia se encuentra como líquido y como vapor, es decir, que las fases líquida y vapor conviven en equilibrio.

La cuarta zona es un punto específico el cual se conoce como vapor saturado (g). En este punto la ultima molécula de sustancia líquida se evapora.

La quinta zona que tenemos es la zona de vapor sobrecalentado. En esta zona el vapor de la sustancia se encuentra a una temperatura mayor a la del punto de ebullición.
Si en esta gráfica empezamos aumentar la presión, la zona de mezcla empezará a ser mas pequeña hasta que el líquido saturado y el vapor saturado se vuelven un solo punto. A este punto se le conoce como punto crítico. En este punto los estados de líquido saturado y vapor saturado son los mismos.
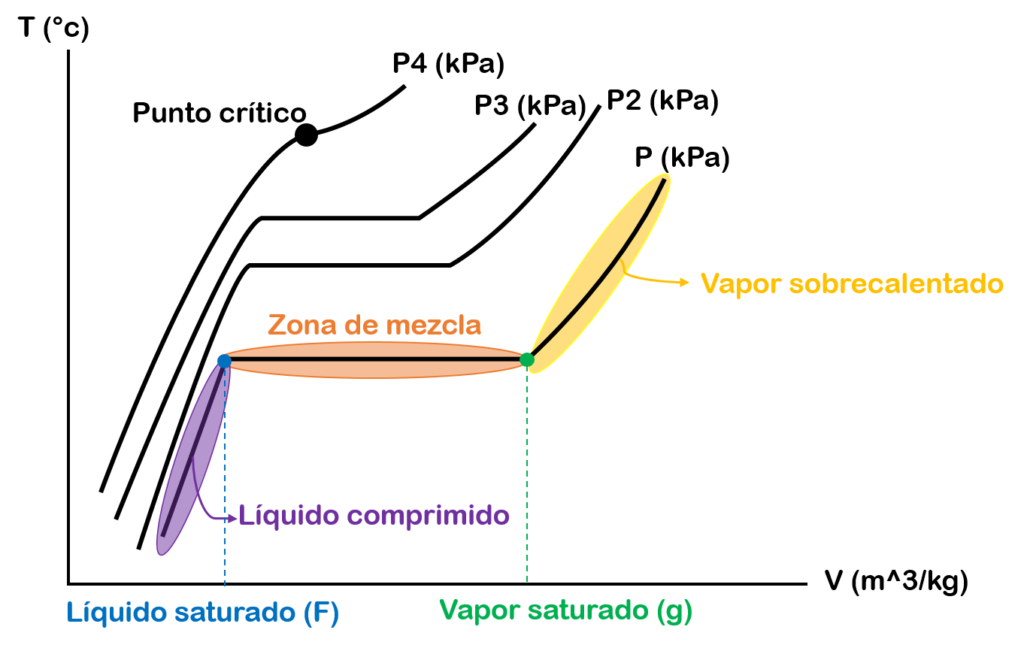
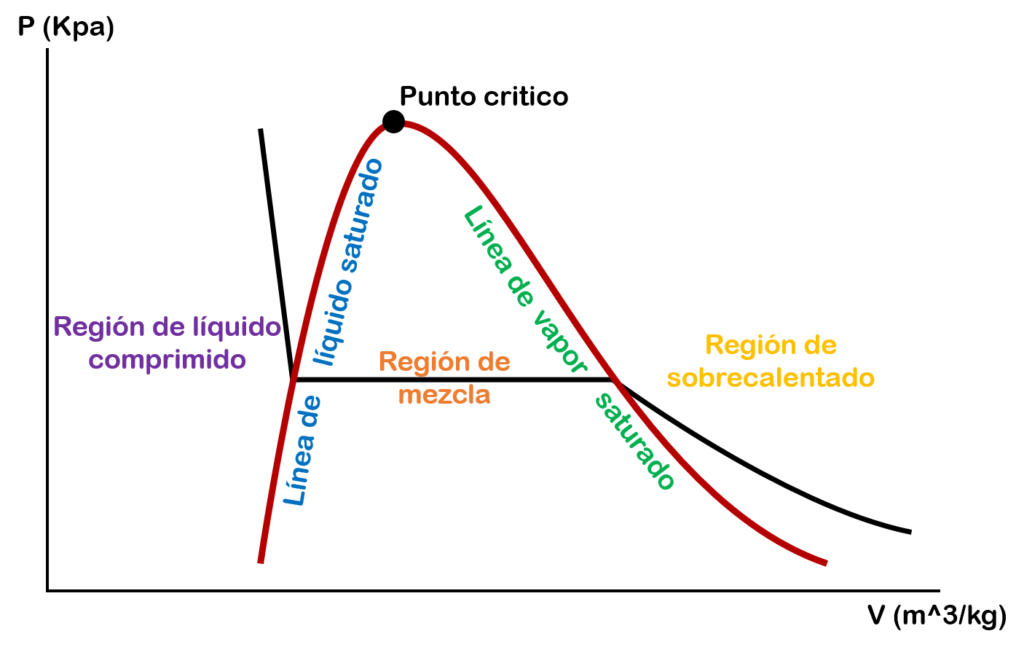
Diagrama de presión vs volumen específico
En la gráfica de presión vs volumen específico tenemos en el eje Y la presión, en el eje X el volumen específico y la línea de la mitad representa una isoterma o línea de temperatura constante.
Pero debes tener en cuenta que en el eje X no solo puede ir el volumen, también puedes colocar otras propiedades como la energía interna, la entalpía y la entropía.

Pero ¿Cómo sabemos en que fase esta la sustancia en el diagrama P vs V?
Para conocer la fase en que se encuentra nuestra sustancia vamos a dividir el diagrama por partes o zonas.
La primera zona que tenemos es la zona de líquido comprimido o líquido subenfriado.

La segunda zona es un punto específico el cual se conoce como líquido saturado (f).

La tercera zona que tenemos es la zona de vapor húmedo o mezcla saturada de líquido – vapor.

La cuarta zona es un punto específico el cual se conoce como vapor saturado (g).
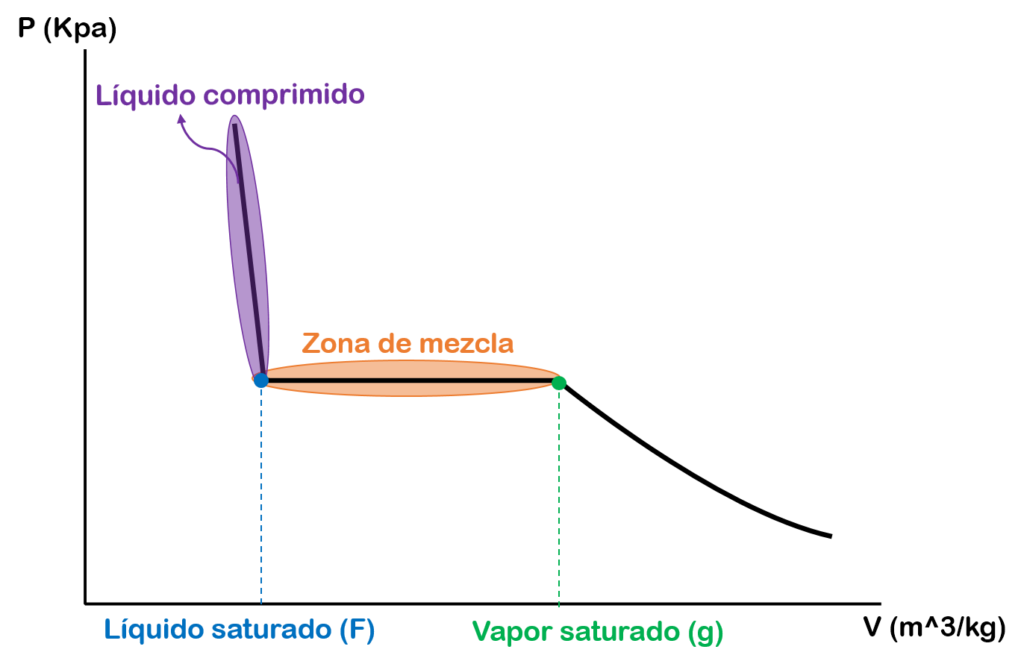
La quinta zona que tenemos es la zona de vapor sobrecalentado.

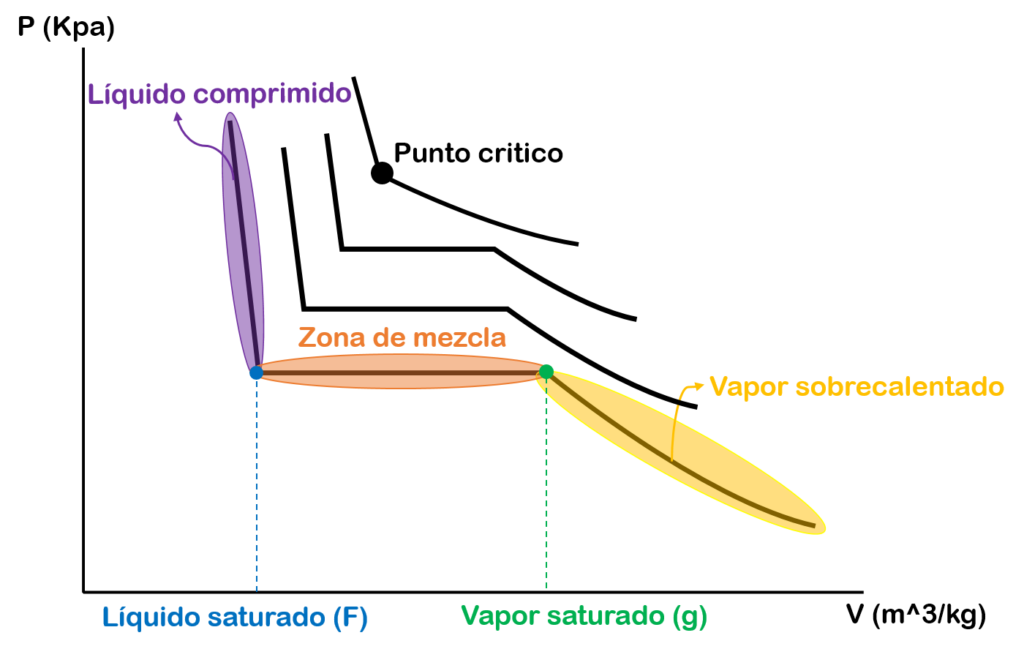
Si en esta gráfica empezamos aumentar la temperatura, la zona de mezcla empezará a ser más pequeña hasta que el líquido saturado y el vapor saturado se vuelven un solo punto. A este punto se le conoce como punto crítico. En este punto los estados de líquido saturado y vapor saturado son los mismos.
El domo de saturación
Por último, si unimos todos los puntos de líquido saturado, vapor saturado y punto crítico en el diagrama T vs V y en el diagrama P vs V vamos a obtener un domo de saturación. De este domo podemos concluir:
- Todo lo que está a la izquierda del domo corresponde al líquido comprimido.
- La línea del domo que une todos los puntos hasta el punto crítico corresponde al líquido saturado.
- Todo lo que está dentro del domo corresponde a la zona de mezcla.
- La línea del domo que une todos los puntos después del punto crítico corresponde al vapor saturado.
- Todo lo que está a la derecha del domo corresponde al vapor sobrecalentado.
Diagrama temperatura vs volumen específico con el domo de saturación
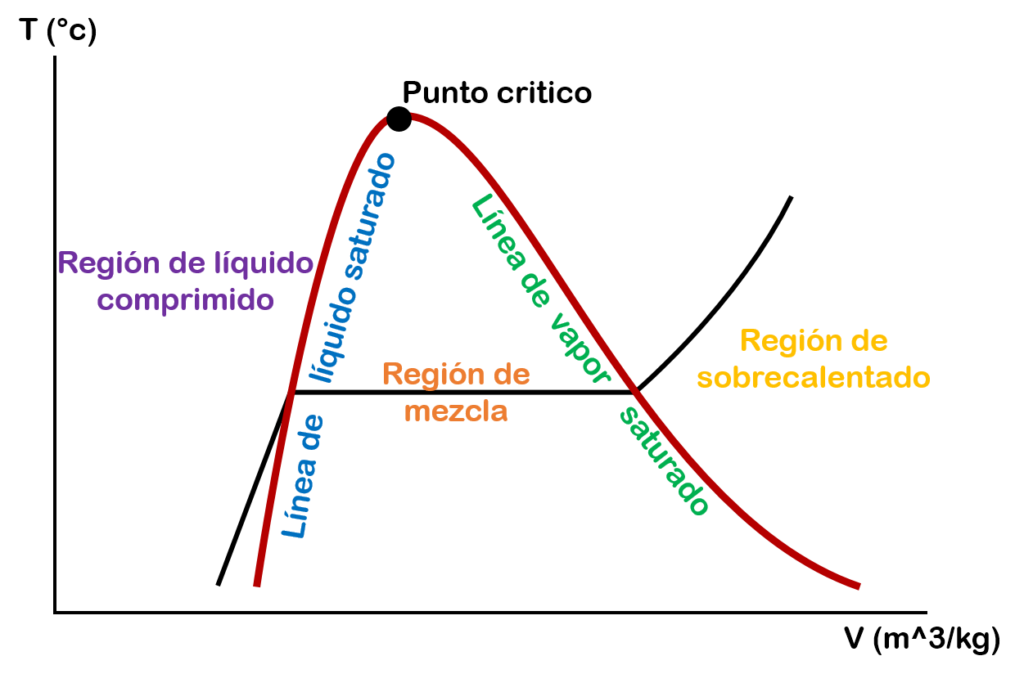
Diagrama presión vs volumen específico con el domo de saturación
En conclusión los diagramas termodinámicos son de vital importancia a la hora de resolver un problema de termodinámica, ya que con ellos podemos ver gráficamente los cambios de fase de la sustancia para conocer las propiedades termodinámicas.

